L'OPTOGÉNÉTIQUE : CONTRÔLER LE CERVEAU AVEC DE LA LUMIÈRE
Notre cerveau est sans nul doute la machine la plus complexe qui soit. Il faut dire que chez nous les humains, on y trouve pas loin de 100 milliards de neurones, reliés entre eux par près d’un million de milliards de connexions.
Pas étonnant que l’on ait du mal à comprendre comment fonctionne ce satané cerveau !
Et pourtant depuis une dizaine d’années, une technique nouvelle est apparue, qui est peut-être en passe de révolutionner les neurosciences : l’optogénétique.
Le cerveau, un organe délicat à étudier
Un cerveau, c’est donc un gros paquet de neurones reliés entre eux, et qui passent leur temps à s’activer et se désactiver. Quand un neurone est activé, il envoie un signal électrique vers les autres neurones auxquels il est connecté : on dit que le neurone décharge.
En simplifiant on peut donc voir le cerveau comme une énorme machine comportant des milliards d’interrupteurs qui passeraient leur temps à alterner entre « on » et « off ». Et que faites-vous en temps normal pour essayer de comprendre le fonctionnement d’une machine pleine de boutons ? Pour ma part, j’appuie sur tous les boutons les uns après les autres et je regarde ce qui se passe !
Le problème c’est qu’on ne peut pas faire ça avec le cerveau ! Il est en effet quasi-impossible de stimuler uniquement un neurone donné tout en laissant les autres inchangés. On en est donc généralement réduits à observer le cerveau en train de fonctionner, et à essayer d’en déduire quelque chose sur le rôle de neurones ou de zones cérébrales données.
Comment stimuler les neurones ?
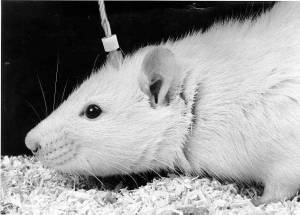
Bien sûr, dans certains cas, il est possible d’activer une région du cerveau qui nous intéresse en y enfonçant une électrode délivrant des impulsions électriques (comme ci-contre sur une souris). Mais cette méthode a le défaut d’exciter généralement toute une zone, sans permettre de cibler un type de neurones donné.
Une alternative consiste à injecter des molécules capables de se fixer sur certaines catégories de neurones pour les stimuler ou les inhiber. Cela peut permettre de mieux cibler, mais dans ce cas on perd toute réactivité car les effets se manifestent sur des échelles de temps de plusieurs heures. Pas idéal quand on sait que dans le cerveau, les signaux agissent en quelques millisecondes !
Le rêve, ce serait donc de disposer d’une technique permettant à la fois de cibler certains neurones de manière sélective, tout en permettant des stimulations sur des très courtes périodes de temps.
Eh bien c’est précisément ce que permet de faire l’optogénétique !
Mais pour comprendre comment marche cette technique, il faut d’abord réviser la manière dont fonctionnent les communications dans notre cerveau.
Le cerveau, un circuit électrique géant ?
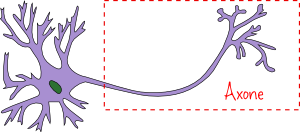 Dans la configuration la plus classique, un neurone du cerveau peut être relié à un autre au moyen d’un prolongement appelé axone, qui permet la propagation des signaux électriques. Il est assez tentant de voir l’axone comme un fil conducteur transportant de l’électricité, mais nous allons voir que cette analogie est un peu incorrecte.
Dans la configuration la plus classique, un neurone du cerveau peut être relié à un autre au moyen d’un prolongement appelé axone, qui permet la propagation des signaux électriques. Il est assez tentant de voir l’axone comme un fil conducteur transportant de l’électricité, mais nous allons voir que cette analogie est un peu incorrecte.
Un peu partout dans notre corps se promènent des ions, c’est-à dire-des atomes chargés : certains positivement comme Na+ ou K+, d’autres négativement comme Cl-. Or la répartition de ces ions n’est pas la même de chaque côté de la membrane qui délimite les neurones : la charge est ainsi légèrement inférieure à l’intérieur. Il en résulte une petite différence de potentiel d’environ -70mV de part et d’autre de la membrane de nos neurones. On dit qu’elle est polarisée. Toute fois les neurones sont capables de modifier cette polarisation, et l’ingrédient qui leur permet de le faire est une protéine insérée dans leur membrane : le canal sodium.
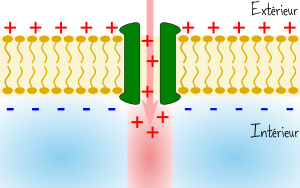 Le canal sodium se comporte en effet comme une porte capable de laisser passer ou non des ions Na+ de l’extérieur vers l’intérieur. Lorsque cela se produit, la charge à l’intérieur augmente et le potentiel peut passer de -70 à +100mV, seuil au delà duquel le canal sodium se referme et la polarisation retombe à -70mV.
Le canal sodium se comporte en effet comme une porte capable de laisser passer ou non des ions Na+ de l’extérieur vers l’intérieur. Lorsque cela se produit, la charge à l’intérieur augmente et le potentiel peut passer de -70 à +100mV, seuil au delà duquel le canal sodium se referme et la polarisation retombe à -70mV.
Cette modification momentanée de la polarisation ne prend que quelques millisecondes et s’appelle un potentiel d’action. Au départ, ce dernier va être généralement créé dans la partie principale du neurone. Il nous faut maintenant comprendre pourquoi ce potentiel peut se propager le long de l’axone.
Ce qui permet cette propagation, c’est une particularité de ces canaux laissant passer les ions sodium : ils ont tendance à s’ouvrir justement si leur voisinage se dépolarise. Ainsi si un canal s’ouvre, une dépolarisation a lieu, stimulant l’ouverture du canal voisin, et ainsi de suite par effet domino tout le long de l’axone. Et c’est grâce à cette sorte de réaction en chaîne qu’un signal peut se propager le long de l’axone d’un neurone jusqu’aux neurones auxquels il est connecté. C’est comme ça que le neurone décharge.
La channelrhodopsine : l’ingrédient clé de l’optogénétique
Maintenant que nous avons vu comment se propagent les communications électriques dans les cellules, je peux vous présenter la star du show, l’ingrédient clé de l’optogénétique : la channelrhodopsine 2 (ChR2 pour les intimes).
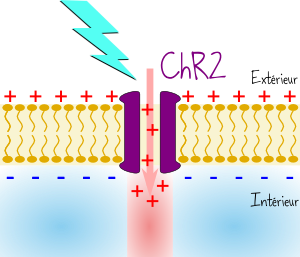 La ChR2 est une protéine découverte en 2002 dans une algue unicellulaire répondant au doux nom deChlamydomonas reinhardtii [1]. Elle ressemble beaucoup au canal sodium, puisqu’elle s’insère dans la membrane des cellules et peut laisser passer des ions. Mais sa grosse particularité, c’est que son ouverture est commandée par la lumière !
La ChR2 est une protéine découverte en 2002 dans une algue unicellulaire répondant au doux nom deChlamydomonas reinhardtii [1]. Elle ressemble beaucoup au canal sodium, puisqu’elle s’insère dans la membrane des cellules et peut laisser passer des ions. Mais sa grosse particularité, c’est que son ouverture est commandée par la lumière !
En effet quand on lui balance de la lumière bleue, la protéine ChR2 change de forme et donne naissance à un petit trou d’environ 6 Angström, suffisant pour laisser passer les ions à l’intérieur de la membrane.
C’est en lisant une publication sur ChR2 que le biologiste Karl Deisseroth et son équipe ont eu l’idée qui est à la base de l’optogénétique : si la ChR2 se comporte comme un canal répondant à la lumière, on peut l’utiliser pour faire décharger des neurones à la demande !
L’expérience fondatrice a ensuite eu lieu en 2005 à l’université de Stanford au Etats-Unis. Deisseroth et sa bande ont cultivé dans une boite de Pétri des neurones dans lesquels ils ont implanté la protéine ChR2. Et ils ont ensuité observé que ces derniers se mettaient à décharger quand on les éclairait avec de la lumière bleue! [2]
Voici donc la technique que tout le monde attendait ! Un moyen d’activer les neurones d’une région donnée simplement en leur envoyant de la lumière. Restait à mettre en place la technique avec un vrai cerveau.
Contrôler le cerveau avec de la lumière
Il n’a pas fallu longtemps pour que l’équipe montre la possibilité de modifier le comportement d’un cerveau à l’aide de lumière. La vidéo ci-dessous est extraite d’un travail publié par l’équipe de Karl Deisseroth [3]. On y voit une souris à qui on a administré la protéine ChR2 et greffé une fibre optique pouvant amener la lumière jusqu’à son cerveau.
Comme vous pouvez le voir, quand la lumière bleue est allumée, la souris se met à tourner frénétiquement dans le sens contraire des aiguilles d’une montre. Et elle s’arrête quand on éteint le signal lumineux.
D’accord, c’est un peu effrayant voir cruel. Mais vous imaginez bien que le but de la technique n’est pas de s’amuser et de rigoler sur le dos de nos amis les rongeurs.
L’optogénétique permet en effet de stimuler de manière rapide et ciblée des zones et des neurones précis du cerveau, et de comprendre l’impact de leur activation sur le comportement de l’animal. C’est donc un moyen formidable de démêler l’écheveau de connexion neuronales de notre organe préféré, et de mieux comprendre comment il est câblé.
A ce stade, vous pouvez vous demander quel est l’avantage de la méthode par rapport à la stimulation électrique classique, où l’on enfonce des électrodes dans le cerveau pour balancer des impulsions électriques. Eh bien la principale différence c’est qu’avec l’optogénétique, on peut cibler des types de neurones donnés. Car tous les neurones ne sont pas identiques !
Prenons par exemple les neurones dopaminergiques, ceux qui utilisent cette hormone appelé dopamine. Ces neurones sont comparativement très peu nombreux (de l’ordre de seulement 400 000 dans le cerveau humain), et ils jouent pourtant un rôle essentiel, au point que leur dysfonctionnement est considéré comme une des causes de la maladie de Parkinson. Un des traitements de la maladie de Parkison consiste justement à réaliser des stimulations à l’aide d’électrodes implantées dans les zones profondes du cerveau. Ce traitement semble fonctionner dans certains cas, mais les raisons de son efficacité ne sont pas encore très claire. Grâce à l’optogénétique, il a été possible d’élucider certains de ces mécanismes [4] en stimulant de manière sélective certains types de neurones.
Mais pour faire ces stimulations ciblées, il faut s’arranger pour que la fameuse protéine ChR2 ne se retrouve que dans les neurones que l’on souhaite étudier. Et ça c’est la partie « génétique » de l’optogénétique.
Contrôler l’expression de la ChR2
Pour l’instant, j’ai un peu passé sous silence la manière dont on s’y prend pour que la protéine ChR2 se retrouve insérée dans la membrane des neurones. Rappelons-le : au naturel, cette protéine est produite dans une algue unicellulaire bien spécifique, mais pas du tout dans le cerveau des animaux. Pour que ça marche, il faut donc faire en sorte que les neurones que l’on cible se mettent à produire cette protéine.
Comme vous le savez peut-être, dans le monde du vivant, les protéines sont produites à partir de l’ADN. Une partie des gènes servent en effet de plan de montage pour fabriquer les protéines. Donc pour qu’une cellule se mette à produire la protéine ChR2, il faut lui fournir l’ADN correspondant qu’on aura préalablement extrait de notre algue unicellulaire.
Il existe plusieurs méthodes pour cela, mais la plus conventionnelle consiste à encapsuler dans un virus la séquence ADN qui nous intéresse, et à envoyer le virus en question infecter l’organisme cible. A l’aide de techniques classiques du génie génétique (comme l’utilisation de promoteurs), on peut même faire en sorte que seuls certains types de neurones fabriquent effectivement la ChR2 à partir de l’ADN injecté. Et c’est comme ça que la ChR2 ne se retrouve que dans les neurones qui nous intéressent, et que l’on peut ensuite contrôler à l’aide de la lumière.
Par exemple sur la vidéo ci-dessous, on voit comment le contrôle optogénétique de certains neurones provoque un comportement boulimique chez la souris [5].
Encore une fois le but n’est pas s’amuser, mais de mieux comprendre par exemple quels sont les circuits de notre cerveau qui sont impliqués dans les dérèglements de l’appétit.
L’avenir de l’optogénétique ?
A ce jour, ce sont probablement plus de 1000 laboratoires de recherche différents qui ont bénéficié de la technique mise au point par Karl Deisseroth et son équipe. Si certains leur prédisent déjà le prix Nobel, d’autres dénoncent le fait que la technique soit trop devenue tellement « tendance » qu’on se retrouve à l’utiliser même là où elle ne serait pas franchement nécessaire (eh oui, en sciences aussi il y a des effets de mode !)
Malgré tout, le domaine de recherche reste très actif, et de nombreux progrès ont été faits, notamment pour créer artificiellement d’autres protéines similaires à la ChR2, mais agissant de manière différente (par exemple en jouant le rôle d’inhibiteur au lieu d’activateur, en réagissant à des couleurs différentes ou avec des temps de réponse modifiés.)
Quoiqu’il en soit il faut noter qu’à ce jour son utilisation pour les primates reste très limitée, et on est probablement encore loin de pouvoir l’utiliser à des fins thérapeutiques sur l’être humain. Malgré tout, les expériences d’optogénétique sur nos amis les rongeurs vont certainement continuer à nous en apprendre beaucoup sur le fonctionnement du cerveau.